YENİ BİR METABOLİK ORGAN: “İNTESTİNAL MİKROBİYOTA”
Yazı Boyutunu Değiştirebilirsiniz
Doğduğumuz andan itibaren vücudumuzda bize eşlik eden çok sayıda mikroorganizma mevcuttur. İnsan vücudu, çoğunluğunu bakterilerin oluşturduğu mantar, virüs ve protozoaları içeren mikrobiyal populasyon barındırmaktadır. Bakteriler genellikle hastalık yapıcı patojenler olarak bilinmektedir. Oysa ki insanlar bakterilerle simbiyotik bir denge içinde yaşamaktadır. Sağlıklı kalmamız için bakterilere ve onların faydalı etkilerine gereksinimimiz olduğu unutulmamalıdır.

İnsan vücudunda çoğunluğunu bakterilerin oluşturduğu mantar, virus ve protozoonları içeren farklı birçok mikrobiyal populasyon konaklamaktadır. Bu populasyon insan hücrelerinden 10 kat fazla mikrobiyal hücre ve insan genomundan 150 kat fazla gen içerir. Bedenimizi paylaşan kommensal, simbiyotik ve patojenik mikroorganizmaların oluşturduğu bu ekolojik topluluğa “mikrobiyota” denmektedir. “Mikrobiyom” ise bu çevrede yaşayan mikroorganizmaların toplam genomu olarak tanımlanmaktadır. (1)
İnsan mikrobiyotası deri, genitoüriner sistem, solunum sistemi ve en çok da gastrointestinal sistemde kolonize olmuştur. Gastrointestinal sistem yaklaşık 200m² yüzey alanı ve mikroorganizmalar için zengin besin öğeleri içermesi sebebi ile vücudumuzdaki en zengin mikroorganizma topluluğunu barındırmaktadır. Sağlıklı bireylerde mikrobiyota çok sayıda ve çeşitli mikroorganizmaları içerir. Doğumdan hemen sonra oluşmaya başlar. Beslenme, genetik, yaş ve yaşanılan coğrafi bölgeye göre değişiklik gösterir. Bakteri sayısı ağızda 10⁹ ml/tükrük, midede 102-4g/materyal iken, kolonda 10¹¹ g/materyal, dışkıda ise 10¹² g/materyaldir. Bebeklerde doğum şekli, beslenme şekli, genetik faktörler mikrobiyotayı etkiler. Enfeksiyonlar, antibiyotik kullanımı gibi tedavi uygulamaları sonrası bağırsak mikrobiyotası değişebilir (2).
Diyet içeriği intestinal floranın değişiminde önemli rol oynamaktadır. Lifli gıdalardan zengin beslenme, Eubacterium rectale, Eubacterium halli, Rumicoccus bromii gibi Firmicutes cinsi bakterilerin çoğalmasını kolaylaştırmaktadır (Resim 1).

Resim 1: Beslenmenin intestinal mikrobiyota üzerine etkisi (Flint ve ark .) WK : Buğday içeren gıda BS : Lif içeren gıda EW: Protein içeren gıda
İntestinal mikrobiyota; vücudumuzda fizyolojik, metabolik ve immun sistem üzerinde oldukça kompleks ve aktif görevler üstlenmektedir. Bağırsak bakterileri enerji taşıyıcı rolü üstlenerek veya immun modüle edici maddeleri serbest bırakarak gerekli metabolik süreçleri kontrol eder. Bu nedenle intestinal mikrobiyota günümüzde yeni bir “metabolik organ” olarak tanımlanmaktadır (3).
Kommensal Bağırsak Bakterileri;
• Sindirilemeyen besinleri parçalayarak vücuda yararlı hale getirir.
• Kompleks karbonhidrat ve liflerin sindirimini destekler.
• Patojenik bakterilerin çoğalmasını engeller.
• B1, B2, B6, B12 ve K vitaminlerinin üretimine katkıda bulunur.
• Toksin ve atıkların detoksifikasyonuna katkıda bulunur.
• Gıdalarla alınan karbonhidrat ve proteinleri fermente ederek laktik asit, butirik asit, asetik asit gibi kısa zincirli yağ asitlerine ve hidrojen, karbondioksit gibi gazlara dönüştürürler.
• Kısa zincirli yağ asitleri barsak mukoza hücreleri için enerji kaynağıdır.
• Kısa zincirli yağ asitleri intestinal peristaltizmin uygun gerçekleşmesine katkıda bulunur.
• Butirat, Nükleer Faktör Kappa (Faktör NF-kB) transkripsiyonunu ve IL-8 üretimini inaktive ederek güçlü bir anti-inflamatuar etkinlik sağlar. Firmicutes cinsi bakterilerin, özellikle Faecalibacterium prausnitzii ‘nin butirat üretiminde en etkin rolü oynadığı kabul edilmektedir. Bu bakteriler , bağırsak florasının % 5-15’ini oluşturur. Alfa 1 antitripsin, kalprotektin gibi akut faz reaktanı proteinler intestinal mukozada inflamatuar iritasyondan sorumludur.
F. prausnitzii azalması inflamasyon derecesinde artışla korelasyon gösterir.
• Sağlıklı kişilerde kolon epitel hücreleri koruyucu mukoza tabakasıyla örtülüdür. Verrucomicrobia cinsi bakteriler , özellikle Akkermansia muciniphila goblet hücrelerinden mukoza üretimini destekleyerek immun modulasyona katkıda bulunur. Mukoza tabakası hasara uğradığında ya da musin üretimi yetersiz kaldığında patojen, kirletici ve alerjen maddeler doğrudan mukozal hücrelerle temas eder ve inflamasyona neden olur. (4,5)
Disbiyozis
Kronik gastrointestinal hastalıklar, antibiyotik kullanımı gibi nedenlerle bağırsak mikrobiyotası değişebilir. İntestinal mikrobiyota dengesinde bozukluk “disbiyozis” olarak tanımlanmaktadır. Mikrobiyota dengesinde bozulma olduğunda bağırsak geçirgenliğinde artma, kısa zincirli yağ asitleri üretiminde değişme, kolon rezistansında azalma olduğu gösterilmiştir. Firmicutes suşlarında azalma ve Salmonella, Shigella, Klebsiella, Proteus, Escherichia coli gibi Proteobacteria türlerinin artışı, çeşitli hastalıklarla ilişkilendirilmektedir.
Sülfat tüketen bakteriler, hidrojen sülfit (H2S) üretimine yol açarak bağırsak hastalıklarının gelişimine zemin hazırlarlar. H2S intestinal epitelde hasar yapan, buna bağlı olarak hücresel atipiye yol açan toksik bir metabolik üründür. Bilophilia wadworthii, Desulfomonas pigra ve Desulfovibrio piger türleri H2S üretiminde önemli rol oynayan bakterilerdir. Zorunlu anaerob olan Clostridium türleri, immun modulatif etkileri ve IL-10 üretimini arttırmaları sebebiyle patojenik etkileri olan bakterilerdir. Özellikle Clostridium cinsi bakterilerin toksin üreten kökenleri otistik spektrumlu hastalarda saptanmakta, sıklıkla intestinal ve ekstra intestinal otistik yakınmalara yol açmaktadır.
Solunum yolu mukozasında bulunan vepatojen olarak bilinen Haemophilus ve Fusobacteria türleri de bağırsaklarda saptanabilmektedir. Araştırmalar bu patojenik türlerin kronik inflamatuar bağırsak hastalıkları, kolorektal karsinomlar ve apandisit ile ilişkili olduğunu göstermektedir. Dışkıda yapılan moleküler-genetik araştırmalar arttıkça, bu ilişki daha iyi tanımlanacaktır (6,7).
Disbiyozisin Klinik Semptomlarla İlişkisi
İntestinal mikrobiyotanın ayrıntılı analizleriyle oldukça değerli sonuçlar elde edilmiştir. Bağırsak flora populasyonunun ideal organizasyonu, sağlıklı fizyolojik yaşamın ana unsurlarındandır. İntestinal mikrobiyota kişisel olarak tanımlandığında, artmış ya da azalmış kökenlerin varlığına göre diyet düzenlenmes, uygun prebiyotik probiyotiklerin kullanımı gibi çözümler uygulanabilir.
1. Obezite ve Metabolik Sendrom
Sağlıklı kişilerde genellikle Firmicutes/Bacteroidetes oranı 1:1 ile 1:3 oranında değişir. Kilolu kişilerde ise bu oran 3:1 den 25:1 e kadar değişir. Bazı yüksek kilolu kişilerde 200:1 oranına ulaştığı gösterilmiştir (8 ,9).
Obezitenin bir diğer sonucu da firmicute genusuna ait olan Faecalibacterium prausnitzii miktarındaki belirgin azalmadır. F.prausnitzii barsak florasında en sık rastlanan 3 bakteriden biridir. Butirat üretir. Butirat barsak mukozasının gelişimini destekler. Butirik asit tuzları Faktör NF-kB’ nin transkripsiyonunu inhibe eder ek kemokin ve lnterlökin 8 salınımını engeller. Obezlerde, hsCRP ve lnterlökin 6 seviyeleri belirgin artmış , aynı zamanda F.prausnitzii miktarı azalmıştır. Bu hastalarda F.prausnitzii miktarı arttırıldığında mukoza korunabilir ve inflamatuar reaksiyonlar azaltılabilir (4).

Goblet hücrelerinden üretilen mukus yapımına katkıda bulunan A.muciniphila türleri de fazla kilolu kişilerde sıklıkla azalmıştır. Mukus, intestinal epitel hücrelerinin üzerini örterek kimyasal ve mekanik etkilerden koruyan bir bariyer oluşturur. Yüksek yağlı diyetle beslenen kişilerde Akkermansia muciniphila miktarının belirgin olarak azaldığı gösterilmiştir. Bu kişilerin diyetine olligosakkaritler içeren prebiyotikler eklenerek bakteri sayısı kısmen arttırılabilir. Hayvan deneylerinde A. muchiniphila desteğinin kilo vermeye, mukoza tabakası gelişimine, açlık kan glukozu ve insülin direncini azaltmaya olumlu etkileri gösterilmiştir. İnsanlar üzerinde de benzer sonuçlar elde edildiği bildirilmektedir (10).
2. İntestinal İnflamasyon
İrritabl bağırsak sendromu, pek çok kişide rastlanan, yaygın, uzun süreli ve ataklarla kendini gösteren bir klinik tablodur. Son çalışmalarda irritabl kolon yakınmaları ve Crohn hastalığı olan kişilerde F. prausnitzii miktarının yaklaşık %30 oranında azaldığı gösterilmiştir. F. prausnitzii türlerinin anti inflamatuar etkisi olan butirat üretiminde en önemli rolü oynadığı ve butiratın Faktör NF-kB ve IL-8 üzerindeki inhibitör etkisi düşünüldüğünde, bu azalma mukoza üzerindeki anti inflamatuar etkiyi olumsuz yönde etkilemektedir (4,6)
Crohn hastalığı tanısı yeni konulmuş çocukların yaklaşık %70’inde Campylobacter türleri izole edilmektedir. Bu sebeple dışkıda Campylobacter türleri izole edildiğinde probiyotik verilmesinin patojenik bakterileri azaltacağı yönünde tartışmalar giderek artmaktadır (11).
“Aşırı geçirgen bağırsak sendromu (leaky gut syndrome)” intestinal mikrobiyota ile yakından ilişkili olduğu öne sürülen bir klinik paterndir. Bu kişilerde A. muchinophilia ve F. prausnitzii miktarları azalmıştrı. Bağırsak hücreleri yan yana dizilmiş tuğlalar gibidir. Aralarında da tuğlalar arasındaki çimento diyebileceğimiz “sıkı bağlantılar” vardır. Böylelikle istenmeyen maddeler buradan bağırsağın dışına (yani vücudun içine) geçemezler, bağırsak içinde kalarak kalınbağırsaktan atılırlar. Bağırsak hücrelerinin şeklinin ve hücreler arasındaki bağlantının sağlıklı olması için hücrelerin gergin durması gerekir, bu da bağırsakların gergin durmak için yeterli enerjisi olduğunda gerçekleşir. F. prausnitzii türleri besinlerle alınan polisakkaritleri kullanarak kısa zincirli yağ asidi oluştururlar. Kısa zincirli yağ asitlerinden de enerji üretilir. Bağırsağın hemen dış yüzeyinde, bağırsaktan geçen maddeleri inceleyen bağışıklık sistemi hücreleri vardır. Bağırsaktan aşırı bir geçiş olduğu zaman bu bağışıklık sistemi hücreleri aktifleşirler ve bir reaksiyon başlatırlar ama bu reaksiyon hastalık oluşturmayacak kadar azdır.
Buna düşük düzeyli inflamasyon denir. Düşük düzeyli inflamasyon, bağırsak geçirgenliği devam ettiği sürece bitmez, bu da uzun zamanda vücudun bütün enerjisinin bağışıklık sistemi hücreleri tarafından kullanılmasına sebep olur. Dolayısıyla ihtiyacı olan diğer organlara yeterli enerji gidemez ve bu organlarda bazı problemler oluşmaya başlar. Aşırı geçirgen bağırsak sendromunun bir diğer kötü yanı da içeri giren istenmeyen maddelerin vücudun zayıf olan dokularına giderek orada birikmesi ve uzun süreçte bağışıklık sisteminin bu dokulara saldırması ile otoimmün hastalıklara sebep olmasıdır (12,13).
3. İntestinal Tümörler ve İntestinal Kanserler
Diğer bilinen kanserojen etkilerin yanı sıra asitler, özellikle hidrojen sülfat atipik hücre gelişimini arttırır, mukoza iritasyonu yaparak kolorektal kanser yatkınlığına neden olur. Sülfat üreten bakteriler Desulfomonas piger, Desulfovibrio piger ve H2S üreten Clostridium türleridir. Dışkı mikrobiyom analizinde sülfat üreten bakterilerde sayıca artış görüldüğünde pro-prebiyotik terapileri uygulanabilir.
İntestinal tümörlerde de intestinal mikrobiyotanın değiştiği gösterilmiştir. Bu kişilerde sıklıkla F. prausnitzii miktarı saptanamayacak kadar azalmıştır (13).
4. Artrit
Romatoid artritli hastaların intestinal mikrobiyomlarında hastalığın gelişimi ve progresyonuna paralel olacak şekilde bakteriyel dengesizlikler saptanmaktadır . Örneğin Prevotella copri bağırsak mikroflorasında fizyolojik sınırlarda yer aldığında bağışıklık ve sindirim sistemi için yararlıdır. Ancak romatoid artritli hastalarda Prevotella copri ve diğer prevotella türlerinin miktarının çok arttığı saptandığı bildirilmektedir. Bu durumun diğer yararlı bakterilerin üremelerini ve fonksiyonlarını gerçekleştirmelerini engellediği öne sürülmektedir (14).
5. Otizm
Otizmde genetik faktörler büyük rol oynar. Bununla beraber başka pek çok faktör de hastalık gelişimine sebep olabilmektedir. Otistik spektrumu içeren klinik yakınmalara pek çok bağırsak hastalığı da eşlik etmektedir. Çalışmalar antibiyotik kullanımının sadece bağırsak şikayetlerini kolaylaştırmakla kalmadığını, otizmin diğer semptomlarında da artışa yol açtığını göstermektedir. İntestinal mikrofloranın beyin- barsak ekseni üzerinden, beyin gelişimine de katkıda bulunduğu öne sürülmektedir. Bağırsak biyoçeşitliliğinin bozulmasının otizm gelişimine yol açmasının yanı sıra, semptomların şiddetini de arttırdığı bildirilmektedir. Otizmli çocuklarda toksin üreten Clostridium türlerinin arttığı saptanmaktadır. Otizmli çocuklarda , normal nörolojik gelişimi olan kontrol grubuna göre daha fazla miktarda Clostridium türleri izole edilmektedir. Ancak Clostridium türlerinin fazlalığının otizm başlangıcı ve gelişiminde nasıl rol aldığı henüz tam anlaşılamamıştır. Otizmli çocukların dışkılarında Clostridium türlerinin toksin üreten türleri saptandığında uygun probiyotik kullanılması önerilmektedir (7,15).
6. Alzheimer Hastalığı
Yeni bir çalışmada Alzheimer hastalarının intestinal mikrofloralarında F. prausnitzii miktarının %100 oranında azaldığı gösterilmiştir (n=52). Ayrıca bu hastaların dışkılarının %87.5’inde kalprotektin, antitripsin gibi inflamasyon indikatörlerinin arttığı saptanmıştır. hsCRP değerleri bu hastaların %91′ inde yüksektir. Bu veriler vücutta sistemik bir inflamasyon varlığını göstermekte, F. prausnitzii miktarındaki azalmanın, bu inflamasyonun nedeni olabileceği öne sürülmektedir (16). Sonuç olarak, kişisel bağırsak mikrobiyotasının belirlenmesi ile kişiye özel tavsiye ve tedavi yaklaşımları mümkün olmaktadır.
Kaynaklar:
- Turnbaugh, P.J.; Ley, R.E.; Hamady, M.;Fraser-Liggett,C.M.; Knight, R.; Gordon,J.I. (2007). “The Human Microbiome Project”. Nature 449: 804-81O.
- Bull M.J., Plummer N.T.. Part 1: The Human Gut Microbiome in Health and Disease. in: lntegrative Medicine: A Clinician’s Journal 13(6), S. 17-22, 2014
- Jandhyala, S. M. et al: Role of the normal gut microbiota. in: World J Gastroenterol 21(29), S.8787-8803,2015
- Miquel, S. et al.: Faecalibacterium prausnitzii and human intestinal health. in: Curr Opin Microbiol. 16(3), S. 255-261, 2013
- Everard A., et al.: Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. in: PNAS 110(22), S. 9066-9071, 2013
- Ramezani, A. et al.: The Gut Microbiome, Kidney Disease, and Targeted lnterventions. in: JASN 25(4), S. 657-670, 2014
- Song, Y. et al.: Real-Time PCR Quantitation of Clostridia in Feces of Autistic Children . in: AEM 70, S.6459-6465,2004
- The NIH HMP Working Group et al.: The NIH Human Microbiome Project. in: Genome Res. 19, S. 2317-2323, 2009.
- Kasai et al. Comparison ofthe gut microbiota composition between obese and non-obese individuals in a Japanese population, as analyzed by terminal restriction fragment length polymorphism and next-generation sequencing BMC Gastroenterology (2015) 15:100 DOI10.1186/sl 2876-015-0330-2
- Everard, A. et al.: Cross-Talk between Akkermansia muciniphila and lntestinal Epithelium Controls Diet-lnduced Obesity. in: PNAS 110(22), S. 9066-9071, 2013
- Deshpande, N. P. et al.: Comparative genomics of Campylobacter concisus isolates reveals genetic diversity and provides insights into disease association. in: BMC Genomics 14, 585, 2013
- Michielan, A. et al.: lntestinal Permeability in lnflammatory Bowel Disease: Pathogenesis, Clinical Evaluation, and Therapy of Leaky Gut. in: Mediators of lnflammation, 2015, 628157
- Nava G.M. et al.: Abundance and diversity of mucosa-associated hydrogenotrophic microbes in the healthy human colon. in: The iSME Journal 6(1), S. 57-70, 2012
- Seher, J. U. et al.: Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. in: elife, 2, e0l 202, 2013
- Smith, P.A.: Brain, meet gut. in: Nature 526, S. 312-314, 2015
- Leblhuber, F. et al.: Elevated fecal calprotectin in patients with Alzheimer’s dementia indicates leaky gut. J Neural Transm (Vienna) 122(9) S. 1319-1322, 2015
- Mandal, S. et al.: Analysis of composition of microbiomes: a novel method for studying microbial composition. in: MEHD 26, S. 27663-27670, 2015


















 Son yıllarda yapılan çalışmalar; bağırsakların, besinleri sindirim ve emilimi ile su ve elektrolit homeostazisi yanı sıra mukozal bariyer aracılığı ile vücuda yabancı çevresel antijenlerin girişinin önlenmesinde de anahtar rol oynadığını göstermiştir (1). Bağırsak geçirgenliğinin artması sonucu bir çok hastalık gelişebilir ve bu hastalıklar yalnız bağırsak hastalıkları olmayabilir. Tip I Diabetes Mellitus, Multiple Skleroz, Allerji gibi otoimmun hastalıkların yanı sıra birçok hastalık da artmış bağırsak geçirgenliğinin sonucu ortaya çıkabilir. Birçok hastalığın bağırsaklardan başladığını kanıtlayan birçok bulgu vardır. Ancak bu hastalıkların bağırsaklarda lokalize olmaması dikkat çekicidir ve diğer organlarda da oluşabilir.
Son yıllarda yapılan çalışmalar; bağırsakların, besinleri sindirim ve emilimi ile su ve elektrolit homeostazisi yanı sıra mukozal bariyer aracılığı ile vücuda yabancı çevresel antijenlerin girişinin önlenmesinde de anahtar rol oynadığını göstermiştir (1). Bağırsak geçirgenliğinin artması sonucu bir çok hastalık gelişebilir ve bu hastalıklar yalnız bağırsak hastalıkları olmayabilir. Tip I Diabetes Mellitus, Multiple Skleroz, Allerji gibi otoimmun hastalıkların yanı sıra birçok hastalık da artmış bağırsak geçirgenliğinin sonucu ortaya çıkabilir. Birçok hastalığın bağırsaklardan başladığını kanıtlayan birçok bulgu vardır. Ancak bu hastalıkların bağırsaklarda lokalize olmaması dikkat çekicidir ve diğer organlarda da oluşabilir.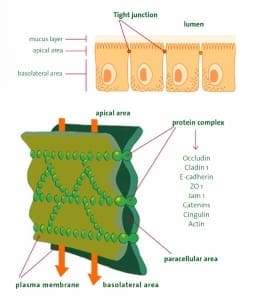 Bağırsak lümeninden dolaşıma geçişte iki yol bulunur. İlki enterositlerin fırçamsı kenarları boyunca ‘’transporter’’ (taşıyıcılar) aracılığı ile olur, buna transsellüler yol denir, pek çok besin maddesinin emilimi bu yolla olur. İkinci yol; hücreler arası boşluklardan parasellüler geçiştir. Bu yoldan iyonlar, suda çözünen moleküller ve nadir mikroorganizmalar geçiş yapar (2,3). Parasellüler geçiş ‘’tight junctions’’ (sıkı kavşaklar) adı verilen protein yapıda kapılar tarafından kontrol edilir. Bu dinamik yapılar beslenme durumu, fiziksel aktivite, hormonal ve sinirsel sinyaller ve inflamatuvar medyatörler ile uyumlu şekilde açılır ve kapatılır (4,5). Bağırsak sıkı kavşakları (tight junctions); besinlerin optimal emilimi ve transportu yanı sıra vücuda yabancı antijenlere karşı tolerans ve immunite arasında denge oluşumunun sağlanmasında da görev alır. Günümüzde bağırsak sıkı bağlantılarının yapısı hakkında önemli bilgiler varolmakla birlikte, fizyolojisi ve patofizyolojisi hakkında bilgilerimiz nispeten sınırlıdır. Zonulin; bu sıkı kavşaklarda anahtar pozisyonunda fizyolojik ve reverzibl bir modülatördür. Bu protein mukozada oluşur ve bağırsak geçirgenliğini direkt olarak kontrol eder (2,6,7). Bağırsak lümenindeki bakteriler veya gıdalardaki tetikleyici maddeler (ör: gluten) gibi uyaranlara yanıt olarak Zonulin lümene salınır ve epitel hücrelerinin apikal yüzeylerindeki reseptörlere bağlanarak sıkı kavşakların bütünlüğünün bozulmasına neden olan yolakları başlatır (8,9). Hücre içi sıkı bağlantılarının bilinen tek fizyolojik modülatörü Zonulin’in keşfi, bağırsak epitelyal parasellüler yolağın, karmaşık mekanizmalarını ve genetik olarak yatkın kişilerde bu mekanizmalardaki bozuklukların, otoimmün hastalıklara neden olduğunu anlamamızı sağladı.
Bağırsak lümeninden dolaşıma geçişte iki yol bulunur. İlki enterositlerin fırçamsı kenarları boyunca ‘’transporter’’ (taşıyıcılar) aracılığı ile olur, buna transsellüler yol denir, pek çok besin maddesinin emilimi bu yolla olur. İkinci yol; hücreler arası boşluklardan parasellüler geçiştir. Bu yoldan iyonlar, suda çözünen moleküller ve nadir mikroorganizmalar geçiş yapar (2,3). Parasellüler geçiş ‘’tight junctions’’ (sıkı kavşaklar) adı verilen protein yapıda kapılar tarafından kontrol edilir. Bu dinamik yapılar beslenme durumu, fiziksel aktivite, hormonal ve sinirsel sinyaller ve inflamatuvar medyatörler ile uyumlu şekilde açılır ve kapatılır (4,5). Bağırsak sıkı kavşakları (tight junctions); besinlerin optimal emilimi ve transportu yanı sıra vücuda yabancı antijenlere karşı tolerans ve immunite arasında denge oluşumunun sağlanmasında da görev alır. Günümüzde bağırsak sıkı bağlantılarının yapısı hakkında önemli bilgiler varolmakla birlikte, fizyolojisi ve patofizyolojisi hakkında bilgilerimiz nispeten sınırlıdır. Zonulin; bu sıkı kavşaklarda anahtar pozisyonunda fizyolojik ve reverzibl bir modülatördür. Bu protein mukozada oluşur ve bağırsak geçirgenliğini direkt olarak kontrol eder (2,6,7). Bağırsak lümenindeki bakteriler veya gıdalardaki tetikleyici maddeler (ör: gluten) gibi uyaranlara yanıt olarak Zonulin lümene salınır ve epitel hücrelerinin apikal yüzeylerindeki reseptörlere bağlanarak sıkı kavşakların bütünlüğünün bozulmasına neden olan yolakları başlatır (8,9). Hücre içi sıkı bağlantılarının bilinen tek fizyolojik modülatörü Zonulin’in keşfi, bağırsak epitelyal parasellüler yolağın, karmaşık mekanizmalarını ve genetik olarak yatkın kişilerde bu mekanizmalardaki bozuklukların, otoimmün hastalıklara neden olduğunu anlamamızı sağladı.